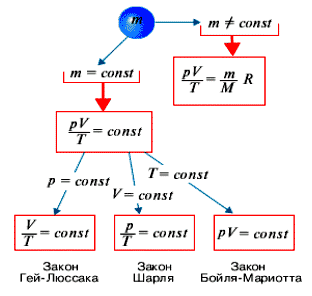
Закон Бойля-Мариотта — один из основных законов физико-химической термодинамики, который описывает взаимосвязь объема газа и его давления при неизменной температуре. Закон формулировали и ранее независимо друг от друга открыли Роберт Бойль и Эдмонд Мариотт на рубеже 17-18 веков. Согласно этому закону, при постоянной температуре и количестве газа, произведение давления и объема газа остается постоянным.
Этот закон лег в основу общей газовой формулы, которая выражается следующим образом: P₁V₁ = P₂V₂, где P₁ и P₂ обозначают давление газа в начальном и конечном состоянии соответственно, а V₁ и V₂ — его объем в этих состояниях. Формула позволяет вычислить давление или объем газа в любом другом состоянии, зная значения этих параметров в одном состоянии.
Применение закона Бойля-Мариотта находит в широком спектре областей физики и химии. Он позволяет анализировать и предсказывать изменения в объеме и давлении газа при изменении одного из этих параметров. Например, закон Бойля-Мариотта используется при расчете давления в шприце, при изучении свойств газовых смесей, а также при проведении экспериментов с аэрозолями и атмосферным давлением.
Формула закона Бойля-Мариотта
Закон Бойля-Мариотта устанавливает обратную пропорциональность между давлением и объемом газа при постоянной температуре: если температура газа не меняется, а количество вещества остается постоянным, то при увеличении давления его объем уменьшается, и наоборот.
Формула закона Бойля-Мариотта имеет следующий вид:
p1 * V1 = p2 * V2
где p1 и p2 — начальное и конечное давление газа, а V1 и V2 — начальный и конечный объем газа.
Закон Бойля-Мариотта находит применение во многих областях физики, например, при решении задач на газовые законы или при расчете давления и объема газовых смесей в химических реакциях.
Определение и основные принципы
Закон Бойля-Мариотта представляет собой физический закон, который определяет взаимосвязь между объемом, давлением и температурой идеального газа. В своей основе закон утверждает, что при постоянной температуре для идеального газа объем прямо пропорционален его давлению. Другими словами, если давление идеального газа увеличивается при постоянной температуре, его объем будет уменьшаться, и наоборот.
Основные принципы закона Бойля-Мариотта могут быть сформулированы следующим образом:
- При неизменной температуре, объем идеального газа обратно пропорционален его давлению. То есть, при увеличении давления объем газа снижается, и наоборот.
- Этот закон верен только для идеального газа, то есть газа, у которого межмолекулярные силы пренебрежимо малы.
- Закон Бойля-Мариотта также предполагает постоянство температуры. Если температура идеального газа изменяется, то этот закон не выполняется.
Формула, которая описывает закон Бойля-Мариотта, выглядит следующим образом:
P1 × V1 = P2 × V2
где P1 и V1 — исходное давление и объем газа, а P2 и V2 — новое давление и объем газа после изменения условий.
Закон Бойля-Мариотта имеет много практических применений. Он используется для решения задач, связанных с изменением объема и давления газа при изменении условий, таких как сжатие или расширение газовой смеси. Этот закон также помогает объяснить явления, связанные с работой двигателей внутреннего сгорания, таких как сжатие смеси в цилиндре автомобиля.
Закон Бойля-Мариотта: понятие и история
Роберт Бойль, английский физик и химик, проводил серию экспериментов с газами и открыл, что при постоянной температуре объем газа обратно пропорционален давлению, под действием которого находится газ. Формулировка закона Бойля звучит следующим образом: «При постоянной температуре объем заданного массы газа обратно пропорционален давлению, под которым этот газ находится». Простыми словами, если увеличить давление на газ, его объем уменьшится, и наоборот.
В то же время, французский физик и химик Эдме Мариотт проводил независимые эксперименты и пришел к аналогичным результатам. Он открыл, что при постоянном объеме газа его давление пропорционально его температуре в абсолютных единицах. Таким образом, был сформулирован закон Мариотта, который гласит: «При постоянном объеме и постоянном составе газовая температура и давление газа пропорциональны друг другу».
Оба закона были объединены в единое выражение, которое сейчас называется законом Бойля-Мариотта. Он устанавливает, что при постоянной температуре давление и объем заданного массы газа обратно пропорциональны друг другу. То есть, если увеличить давление на газ, его объем уменьшится, а при уменьшении давления — увеличится. Данный закон справедлив для идеальных газов, которые подчиняются определенным предположениям.
| Ученый | Описание |
|---|---|
| Роберт Бойль | Английский физик и химик, открыл закон Бойля, возможность сжатия или разжатия газа и обратную пропорциональность объема и давления. |
| Эдме Мариотт | Французский физик и химик, открыл закон Мариотта, относительную плотность воздуха и зависимость его плотности от температуры. |
Математическая формулировка закона Бойля-Мариотта
Математически формула закона Бойля-Мариотта выглядит следующим образом:
P1 * V1 = P2 * V2
где P1 и P2 — начальное и конечное давление газа соответственно, а V1 и V2 — начальный и конечный объем газа соответственно.
Используя эту формулу, можно определить изменение давления или объема газа при известных начальных и конечных значениях одного из этих параметров.
Например, если изначальный объем газа составляет 10 литров при давлении 1 атмосфера, а затем давление увеличивается до 2 атмосфер, можно использовать формулу, чтобы определить конечный объем газа:
P1 * V1 = P2 * V2
1 атм * 10 л = 2 атм * V2
Отсюда можно найти, что V2 = 5 л. То есть при удвоении давления объем газа сокращается в два раза.
Таким образом, математическая формулировка закона Бойля-Мариотта позволяет описать зависимость между давлением и объемом газа и использовать ее для решения различных задач в физике и химии.
Интерпретация формулы и основные формулы для расчетов
Закон Бойля-Мариотта описывает зависимость между объемом, давлением и температурой идеального газа. Согласно этому закону, при постоянной температуре объем идеального газа обратно пропорционален давлению. Формула закона Бойля-Мариотта имеет следующий вид:

где V — объем газа, P — давление газа, k — постоянная, T — абсолютная температура газа.
- При увеличении давления газа при постоянной температуре его объем уменьшается, и наоборот;
- При уменьшении давления газа при постоянной температуре его объем увеличивается, и наоборот;
- Закон Бойля-Мариотта справедлив, если температура газа остается постоянной;
- Закон Бойля-Мариотта не является абсолютным, и его точность снижается при увеличении давления и/или изменении температуры газа.
Основные формулы, которые используются для расчетов по закону Бойля-Мариотта, включают:
- Формула для нахождения объема газа: V = k * P;
- Формула для нахождения давления газа: P = V / k;
- Формула для нахождения постоянной: k = V / P.
Эти формулы позволяют проводить расчеты связанные с изменением объема, давления и температуры идеального газа с использованием закона Бойля-Мариотта.
Применение закона Бойля-Мариотта в физике
Применение закона Бойля-Мариотта в физике находит широкое применение в различных областях, включая химию, метрологию и теплоэнергетику. Вот некоторые из основных применений этого закона:
-
Газовые цилиндры и баллоны: Закон Бойля-Мариотта применяется при расчете объема газа в цилиндрических и баллонных емкостях. Например, при расчете объема кислорода в медицинском баллоне, учитывается давление и температура согласно закону Бойля-Мариотта.
-
Компрессоры и насосы: Закон Бойля-Мариотта также применяется при проектировании и расчете работы компрессоров и насосов. Это позволяет определить соотношение между давлением и объемом газа или жидкости при сжатии или нагнетании.
-
Учение о газе: Закон Бойля-Мариотта лежит в основе учения о газе и позволяет определить изменение объема газа при изменении давления или температуры. Это является фундаментальным понятием при изучении законов и свойств газового состояния.
-
Теплообмен: В области теплообмена закон Бойля-Мариотта применяется для расчета изменения давления и объема газа или жидкости при передаче тепла. Это помогает определить эффективность теплообменных процессов и выбрать оптимальные параметры.
-
Пневматические системы: Закон Бойля-Мариотта применяется в пневматических системах, где давление и объем газа играют ключевую роль в работе этих систем. Применение закона позволяет определить требуемые параметры и производить точные расчеты.
Таким образом, закон Бойля-Мариотта является важным инструментом в физике и находит широкое применение в различных областях. Понимание этого закона позволяет производить точные расчеты и оптимизировать работу систем, связанных с газами и жидкостями.
Газовые сосуды и контейнеры: расчеты объема и давления
Газовые сосуды и контейнеры играют важную роль во многих областях физики и инженерии. Для эффективного проектирования и использования таких сосудов необходимо уметь рассчитывать их объем и давление при заданных условиях.
Расчет объема газового сосуда базируется на физическом законе Бойля-Мариотта, который утверждает, что при постоянной температуре объем газа обратно пропорционален его давлению. Формула для расчета объема газа в идеальном сосуде выглядит следующим образом:
V = nRT/P
Где:
- V — объем газа (в литрах)
- n — количество вещества газа (в молях)
- R — универсальная газовая постоянная (примерно 8.314 Дж/(моль·К))
- T — температура газа (в Кельвинах)
- P — давление газа (в паскалях)
С помощью данной формулы можно рассчитать объем газа в сосуде, если известны остальные параметры. Например, если мы знаем количество вещества газа, его температуру и давление, то сможем определить объем сосуда.
С другой стороны, если известен объем газового сосуда, то можно рассчитать давление газа в нем. Для этого формула Бойля-Мариотта преобразуется следующим образом:
P = nRT/V
Таким образом, имея информацию о объеме сосуда, количестве вещества и температуре, мы можем определить давление газа в сосуде.
Расчеты объема и давления газовых сосудов на основе формулы Бойля-Мариотта позволяют оптимизировать их конструкцию и эффективность использования. Эти расчеты находят применение в промышленности, аэронавтике, химии и многих других областях, где газовые сосуды играют важную роль.
Вопрос-ответ:
Как формулируется закон Бойля-Мариотта?
Закон Бойля-Мариотта формулируется как: при постоянной температуре объем газа обратно пропорционален его давлению.
Какая формула используется для вычисления закона Бойля-Мариотта?
Формула, используемая для вычисления закона Бойля-Мариотта, выглядит так: P₁V₁ = P₂V₂, где P₁ и P₂ — давления газа в начальном и конечном состояниях соответственно, V₁ и V₂ — объем газа в начальном и конечном состояниях соответственно.
Какую роль играют температура и количество вещества в законе Бойля-Мариотта?
Температура и количество вещества не учитываются в законе Бойля-Мариотта, так как он формулируется для газов, у которых эти параметры остаются постоянными.
В каких областях физики применяется закон Бойля-Мариотта?
Закон Бойля-Мариотта широко применяется в газовой физике, а также в областях, связанных с термодинамикой и объемными изменениями газов.
Можете привести пример применения закона Бойля-Мариотта?
Конечно! Например, при сжатии газа в цилиндре поршнем, сила, которую нужно приложить к поршню, можно рассчитать с использованием закона Бойля-Мариотта. Уменьшение объема газа приводит к увеличению его давления, и сила, необходимая для сжатия газа, будет пропорциональна изменению давления.
Как формулируется закон Бойля-Мариотта?
Закон Бойля-Мариотта формулируется следующим образом: при постоянной температуре количество газа обратно пропорционально его объему.