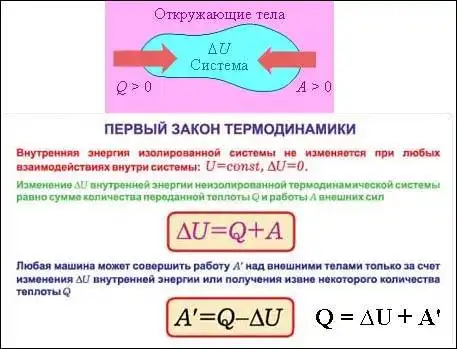
Первый закон термодинамики — один из фундаментальных законов физики, определяющий основные принципы обмена энергии в термодинамических системах. Этот закон формулирует связь между изменением внутренней энергии системы, совершением работы и тепловым обменом.
Формулировка первого закона термодинамики базируется на принципе сохранения энергии и утверждает, что изменение внутренней энергии системы равно сумме работы, совершенной над системой, и тепловому обмену с окружающей средой. То есть, если система получает работу или тепло от окружающей среды, ее внутренняя энергия возрастает, а если энергия передается из системы в окружающую среду, то ее внутренняя энергия уменьшается.
Основными принципами, вытекающими из первого закона термодинамики, являются принцип сохранения энергии и принцип работы. Принцип сохранения энергии утверждает, что энергия не может быть создана или уничтожена, она может только переходить из одной формы в другую. Принцип работы говорит о том, что работа — это энергия, переданная или совершенная телом или системой, и она может быть использована для выполнения работы.
Первый закон термодинамики
Первый закон термодинамики, также известный как принцип сохранения энергии, утверждает, что энергия не может быть создана или уничтожена, а может только переходить из одной формы в другую или переходить из одной системы в другую.
Это означает, что сумма энергии в системе и ее окружении остается постоянной. Если в систему добавляется тепло или выполняется работа, то это приводит к изменению внутренней энергии системы.
Первый закон термодинамики может быть выражен математически следующим образом:
- Изменение внутренней энергии системы равно сумме добавленного тепла и проделанной работы.
- Добавленное тепло — это энергия, переданная системе из-за разницы температур, а работа — это энергия, переданная системе в результате совершения механической работы.
Первый закон термодинамики является основной основой термодинамики и имеет широкое применение в различных областях науки и техники.
Формулировка
Первый закон термодинамики, или принцип сохранения энергии, утверждает, что в изолированной системе энергия не может быть создана или уничтожена, а может только переходить из одной формы в другую. Это означает, что полная энергия системы остается постоянной.
Формулировка закона в математической форме может быть записана как:
ΔU = Q — W
где ΔU — изменение внутренней энергии системы, Q — количество тепла, полученного или отданного системой, W — работа, выполненная системой.
Этот закон является фундаментальным для термодинамики и имеет важное значение во многих областях науки и техники. Он позволяет предсказывать, как может изменяться энергия системы при процессах, таких как нагревание, охлаждение, сжатие или расширение газа, и других термодинамических процессах.
Определение термодинамической системы
Термодинамическая система имеет определенную массу и энергию, которые взаимодействуют с окружающей средой. Отношения массы и энергии между системой и окружающей средой определяют состояние системы.
Состояние термодинамической системы описывается параметрами, такими как температура, давление, объем, внутренняя энергия и другие. Изменение значений этих параметров в процессе взаимодействия системы с окружающей средой определяет характер энергетических процессов в системе.
Термодинамические системы могут быть открытыми, закрытыми или изолированными в зависимости от характера взаимодействия с окружающей средой. Если система обменивает как вещество, так и энергию с окружающей средой, она является открытой. Если система обменивает только энергию, она является закрытой. Если система не обменивает ни вещество, ни энергию с окружающей средой, она является изолированной.
Понимание термодинамической системы является основополагающим в термодинамике, так как она позволяет изучать энергетические процессы, происходящие в системе, а также проводить анализ и оптимизацию энергетических систем в целом.
Математическая формулировка закона
Первый закон термодинамики, также известный как закон сохранения энергии, может быть выражен математическим уравнением. Данное уравнение описывает изменение внутренней энергии системы (ΔU) в терминах теплообмена (Q) и работы (W).
| Формулировка | Уравнение |
|---|---|
| Закон сохранения энергии | ΔU = Q — W |
В данном уравнении ΔU представляет изменение внутренней энергии системы, Q представляет количество тепла, переданного системе, а W представляет выполненную работу над системой. Если система получает тепло, ΔU будет положительным значением, а если система отдает тепло, ΔU будет отрицательным значением. Аналогично, если система выполняет работу, W будет положительным значением, а если система получает работу, W будет отрицательным значением.
Интерпретация закона через понятие энергии
Первый закон термодинамики можно интерпретировать через представление об энергии. Закон утверждает, что полная энергия замкнутой системы остается постоянной.
Энергия представляет собой способность системы производить работу или передавать тепло. Полная энергия включает в себя внутреннюю энергию, кинетическую энергию и потенциальную энергию системы.
Взаимодействие системы со своим окружением может происходить путем передачи энергии в форме работы или тепла. Передача работы осуществляется благодаря разнице в потенциальной энергии или кинетической энергии системы и окружающей среды. Передача тепла происходит за счет разности внутренних энергий.
Согласно первому закону термодинамики, изменение полной энергии замкнутой системы равно сумме внешней работы и тепла, которые передаются системе или выделяются ею. Если внешняя работа и тепло равны нулю, то изменение энергии также будет равно нулю и полная энергия останется постоянной.
Интерпретация закона через понятие энергии помогает понять, как система взаимодействует с окружающей средой и как энергия сохраняется в процессе термодинамических изменений.
Основные принципы
Первый закон термодинамики, также известный как закон сохранения энергии, устанавливает основные принципы взаимодействия энергии в термодинамических системах.
Основные принципы первого закона термодинамики:
| 1. | Энергия не создается и не уничтожается, а только превращается из одной формы в другую. |
| 2. | Возможные виды энергии в системе включают в себя: внутреннюю энергию, кинетическую энергию, потенциальную энергию и энергию, переносимую в виде работы и тепла. |
| 3. | Изменение внутренней энергии системы равно разности между полученной системой тепла и проделанной системой работы. |
| 4. | Энергия может быть перенесена из одной системы в другую в форме работы и/или тепла. |
| 5. | Выполненная работа является формой энергии, которая может быть использована для производства механических движений или как источник энергии для других процессов. |
Понимание этих основных принципов первого закона термодинамики играет важную роль в изучении и анализе термодинамических систем и процессов.
Принцип сохранения энергии
Согласно этому принципу, полная энергия системы остается постоянной со временем, если внутри системы не происходит внешнего воздействия. Это подразумевает, что сумма энергии в различных формах — кинетической, потенциальной и внутренней энергии — остается неизменной.
Одной из важных форм энергии, которая может быть получена или высвобождена в термодинамических системах, является внутренняя энергия. Она представляет собой сумму кинетической энергии молекул и потенциальной энергии их взаимодействий. Первый закон термодинамики утверждает, что изменение внутренней энергии системы равно сумме полученного от системы тепла и совершенной над системой работы.
Таким образом, принцип сохранения энергии играет ключевую роль в термодинамике и является основой расчетов и анализа различных процессов и явлений, связанных с энергией.
| Формулировка закона | Пример |
|---|---|
| Энергия в замкнутой системе постоянна | Кинетическая энергия падающего объекта преобразуется в потенциальную энергию во время подъема |
| Тепло переходит от более теплого объекта к менее теплому | Тепло от кипящего чайника переходит в воду в чашке |
| Изменение внутренней энергии равно теплу и работе | При сжатии газа его внутренняя энергия увеличивается за счет работы сжимающей силы и полученного тепла |
Эквивалентность форм энергии
Первый закон термодинамики устанавливает принцип сохранения энергии в системе. Согласно закону, энергия не может быть ни создана, ни уничтожена, она может только переходить из одной формы в другую.
Энергия может существовать в различных формах, таких как кинетическая энергия (связанная с движением тела), потенциальная энергия (связанная с положением тела в гравитационном поле), внутренняя энергия (связанная с взаимодействием молекул вещества), энергия излучения и т. д.
Важно отметить, что энергия может быть преобразована из одной формы в другую. Например, при падении предмета с определенной высоты, потенциальная энергия будет преобразована в кинетическую энергию. Другим примером может служить переход энергии излучения от солнца в энергию химических связей в процессе фотосинтеза.
Принцип эквивалентности форм энергии означает, что различные формы энергии могут быть преобразованы друг в друга в соответствии с определенным законом сохранения энергии.
Первый закон термодинамики подтверждает, что энергия в системе остается постоянной, если не происходит внешних воздействий на систему. Изменение энергии в системе происходит только в результате перехода энергии из одной формы в другую.
Взаимодействие термодинамических систем
Первый закон термодинамики формулируется как закон сохранения энергии. Он описывает взаимодействие термодинамических систем и говорит о том, что изменение внутренней энергии системы равно разнице между тепловым эффектом и работой, произведенной внешними силами.
Таким образом, взаимодействие термодинамических систем может происходить через передачу тепла или работу. Передача тепла происходит путем контакта между системами и изменения их температур, а передача работы — путем производства механической работы, например сжатие или расширение газа.
Первый закон термодинамики также указывает на то, что энергия не может быть создана или уничтожена, а может только преобразовываться из одной формы в другую. Таким образом, взаимодействие термодинамических систем может приводить к изменению их температуры, объема или давления, но суммарная энергия остается неизменной.
| Взаимодействие | Процесс |
|---|---|
| Теплообмен | Передача тепла от системы с более высокой температурой к системе с более низкой температурой. |
| Механическая работа | Производство работы с помощью внешних сил, например сжатие или расширение газа. |
| Тепловой двигатель | Преобразование тепловой энергии в механическую работу. |
Знание о взаимодействии термодинамических систем позволяет учеть энергетические процессы, происходящие в системах, и определить равновесие или изменения в их состоянии. Это важно для решения многих практических задач, связанных с энергетикой, химией и инженерией.
Вопрос-ответ:
Что такое первый закон термодинамики и каковы его основные принципы?
Первый закон термодинамики — это основной закон физики, который устанавливает, что энергия в изолированной системе не может быть создана или уничтожена, а может только изменять свою форму. Основные принципы первого закона термодинамики включают понятия внутренней энергии, работы и теплоты, а также принцип сохранения энергии.
Какова формулировка первого закона термодинамики?
Формулировка первого закона термодинамики может быть дана следующим образом: изменение внутренней энергии системы равно сумме работы, совершенной над системой, и теплоты, переданной системе. Математически это можно записать как ΔU = Q — W, где ΔU — изменение внутренней энергии системы, Q — теплота, переданная системе, и W — совершенная работа.
Почему первый закон термодинамики называется законом сохранения энергии?
Первый закон термодинамики называется законом сохранения энергии, потому что он устанавливает принцип сохранения энергии в изолированной системе. Согласно этому закону, энергия может переходить из одной формы в другую (работа может превращаться в тепло и наоборот), но общая сумма энергии в системе остается неизменной. Это соответствует общему принципу сохранения энергии, согласно которому энергия не может быть создана или уничтожена, а только преобразована.
Какие основные понятия связаны с первым законом термодинамики?
Основные понятия, связанные с первым законом термодинамики, включают внутреннюю энергию системы, работу и тепло. Внутренняя энергия — это макроскопическая энергия, связанная с движением и взаимодействием атомов и молекул в системе. Работа — это энергия, передаваемая между системой и окружающей средой в результате взаимодействия. Тепло — это энергия, передаваемая между системой и окружающей средой в результате разности температур.