Периодический закон, открытый Д.И. Менделеевым в 1869 году, является одним из основных законов химии. Он описывает закономерности в изменении химических свойств элементов, а также их расположение в периодической системе. Формулировки данного закона основываются на некоторых принципах, которые помогают понять особенности строения и свойств химических элементов.
Первый принцип периодического закона заключается в том, что свойства химических элементов периодически повторяются с изменением их атомных номеров. Это означает, что в периодической системе элементы располагаются по возрастанию атомных номеров, а их химические свойства меняются в соответствии с этим порядком. Таким образом, периодический закон позволяет упорядочить элементы и предсказывать их свойства на основе их положения в системе.
Второй принцип формулировки периодического закона связан с изменением электронной конфигурации элементов. Внутренняя электронная структура атомов определяет их химические свойства, а периодический закон позволяет установить закономерности в этом изменении. С увеличением атомного номера, изменяется число электронов и набор электронных оболочек, что влияет на поведение элементов и их взаимодействие с другими веществами.
Третий принцип формулировки закона Менделеева связан с расположением элементов в периодической системе. Он предписывает, что элементы с схожими химическими свойствами расположены в одной группе (вертикальном столбце) периодической таблицы. Такое объединение элементов в группы позволяет устанавливать общие закономерности и химические свойства для элементов с одинаковым числом электронов во внешней оболочке.
Таким образом, формулировки периодического закона основываются на трех основных принципах: повторении свойств элементов с изменением их атомных номеров, изменении электронной конфигурации и расположении элементов в периодической системе. Эти принципы помогают упорядочить и систематизировать знания о химических элементах, что является основой для понимания и исследования химических реакций и веществ.
Свойства элементов
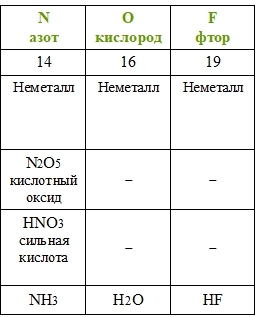
2. Принцип группировки: Химические элементы, которые расположены в одной группе периодической таблицы, имеют схожие свойства. Например, элементы группы щелочных металлов (группа 1) обладают сходными свойствами, такими как активность и способность образовывать щелочные растворы.
3. Принцип периодичности свойств: Химические свойства элементов повторяются с определенным периодом. Это означает, что элементы, находящиеся в одной периоде, имеют схожие свойства. Например, элементы первого периода (водород и гелий) являются газами, а элементы второго периода (лиитий, бериллий) — металлами.
Химические свойства
Химические свойства элементов в периодической таблице определяют их реакционную способность и способность образовывать соединения с другими элементами. Эти свойства могут быть предсказаны и объяснены с помощью периодического закона.
Первый основной принцип периодического закона заключается в том, что химические свойства элементов периодически изменяются с изменением их атомных номеров. Это означает, что элементы схожей реакционной способностью и химическими свойствами располагаются в одной группе периодической системы.
Второй основной принцип периодического закона гласит о том, что свойства элементов изменяются по периодам, то есть горизонтальным строкам периодической таблицы. На каждом новом периоде происходит изменение химических свойств элементов.
Третий основной принцип периодического закона устанавливает, что свойства элементов определяются комплексным взаимодействием электронов во внешнем электронном слое атома. Эти взаимодействия влияют на способность элементов образовывать связи с другими элементами и участвовать в химических реакциях.
Физические свойства
Периодический закон описывает основные закономерности химических элементов и их связь с их атомными свойствами. Однако, помимо этого, есть также ряд физических свойств, которые также периодически изменяются в таблице элементов.
Первое физическое свойство, связанное с периодическим законом, это радиус атома. В периоде элементов атомы постепенно увеличивают свой радиус. Это связано с увеличением количества электронных оболочек и, соответственно, увеличением общего объема атома.
Второе физическое свойство, связанное с периодическим законом, это электроотрицательность. Это показатель способности атома притягивать к себе электроны при образовании химических связей. С ростом электроотрицательности атома, его способность образовывать и удерживать электроны также возрастает.
Третье физическое свойство, связанное с периодическим законом, это плотность. Плотность — это масса вещества, приходящаяся на единицу объема. В таблице периодических элементов можно наблюдать, что плотность элементов, как правило, изменяется по определенному закону: увеличивается к концу периода и увеличивается сверху вниз в столбце с повышением атомной массы.
Атомная структура элементов
Протоны имеют положительный заряд, нейтроны не имеют заряда, а электроны имеют отрицательный заряд. Протоны и нейтроны находятся в ядре атома, а электроны располагаются вокруг ядра по энергетическим оболочкам.
Атомы различных элементов отличаются количеством протонов в ядре, что определяет их атомный номер. Атомы с одинаковым атомным номером, но разным количеством нейтронов, называются изотопами.
Периодический закон гласит, что свойства элементов изменяются периодически в зависимости от их атомных номеров. Это связано с изменением количества электронов в внешней энергетической оболочке атома.
Таким образом, атомная структура элементов играет ключевую роль в формулировке периодического закона и позволяет классифицировать элементы по их свойствам и положению в таблице периодических элементов.
Атомная масса
Атомная масса является одним из фундаментальных понятий в химии и физике. Она позволяет определить количество протонов, нейтронов и электронов в атоме, что влияет на его химические и физические свойства.
Атомная масса элемента представляет собой среднюю массу атомов, присутствующих в природе в виде изотопов этого элемента. Изотопы — это атомы одного и того же элемента, имеющие одинаковое количество протонов, но разное количество нейтронов.
Пример: Атомная масса углерода равна приблизительно 12,01 а. е. м. Это означает, что масса атома углерода составляет около 12 раз больше массы атома водорода, которая равна примерно 1 а. е. м.
Заряд ядра
Заряд ядра является одной из основных характеристик атома и определяет его взаимодействие с другими частицами и полями. Положительный заряд ядра притягивает отрицательно заряженные электроны, которые вращаются вокруг ядра на электронных оболочках.
Благодаря принципу электронейтральности, число протонов в атомном ядре равно числу электронов на оболочках. Это обеспечивает нейтральное состояние атома и отсутствие электрического заряда в целом.
Величина заряда ядра определяет химические и физические свойства атома. Изменение заряда ядра ведет к образованию иона, атома с электрическим зарядом, что в свою очередь приводит к изменению его химических свойств и поведению во внешних условиях.
Количество электронов
Периодический закон устанавливает, что каждый новый период таблицы начинается с заполнения новой энергетической оболочки электронами. Количество электронов на каждой энергетической оболочке определено числом, обозначающим номер периода.
Также периодический закон устанавливает, что на каждой энергетической оболочке может быть определенное количество электронов. Это количество определяется формулой 2n², где n — номер энергетической оболочки. Например, на первой энергетической оболочке может быть не более 2 электронов, на второй — не более 8 электронов, на третьей — не более 18 и так далее.
Таким образом, количество электронов в атоме каждого элемента определяет его свойства и его поведение в химических реакциях.
Вопрос-ответ:
Какие основные принципы формулируют периодический закон?
Основные принципы формулирования периодического закона включают элементы времени, пространства и системности. Временные элементы говорят о том, что закон должен быть действителен на протяжении длительного времени. Пространственные элементы означают, что закон должен применяться ко всем элементам и веществам, находящимся в одинаковых условиях. Системность указывает на то, что закон должен учитывать связь между химическими элементами и их свойствами.
Какие конкретные признаки учитывает периодический закон?
Периодический закон учитывает различные признаки, такие как атомная масса элемента, периодичность свойств элементов, электроотрицательность, ионизационная энергия, радиус атома и т. д. Важно отметить, что периодический закон устанавливает систематическое расположение элементов в таблице Менделеева на основе их признаков, что позволяет предсказывать их свойства и взаимодействия.
Какие причины привели к разработке периодического закона?
Разработку периодического закона привело несколько причин. Первая причина — необходимость упорядочения и классификации элементов, так как к концу 19 века было открыто уже более 60 элементов и было необходимо найти систему, которая помогла бы описать их свойства и связи. Вторая причина — необходимость предсказания существования еще не открытых элементов и их свойств. Третья причина — желание установить систематическую связь между химическими элементами и привести химию к более стройному и научному уровню.
Как периодический закон поможет в изучении и использовании химических элементов?
Периодический закон поможет в изучении и использовании химических элементов, так как он устанавливает систематическое расположение элементов в таблице, позволяя легко найти информацию о их свойствах и химических реакциях. Это поможет ученым предсказывать новые свойства элементов и разрабатывать новые материалы и технологии. Также периодический закон позволяет классифицировать элементы по их химическим свойствам, что помогает в осуществлении различных химических процессов, включая синтез веществ и изучения реакций.
Какие основные принципы лежат в основе формулировки периодического закона?
Периодический закон в химии базируется на трех основных принципах: периодической системе элементов, аномалии группы и периодов, а также закономерностях свойств элементов.
Какая закономерность лежит в основе периодической системы элементов?
Основная закономерность периодической системы элементов заключается в том, что свойства элементов повторяются периодически в порядке возрастания их атомных номеров.